- Συνέντευξη: Ο ερευνητής Διονύσης Αντύπας με απλά λόγια μας μαθαίνει το χαλαρόνιο και τη σχέση του με την σκοτεινή ύλη
- ΝΕLIOTA: Το ερευνητικό πρόγραμμα παρακολούθησης εκλάμψεων λόγω προσκρούσεων παραγήινων αστεροειδών και μετεωροειδών στη Σελήνη
- Podcast: Συζήτηση με τον καθηγητή Νικόλαο Στεργιούλα με αφορμή το σημαντικό εύρημα της εργασίας του για τα άστρα νετρονίων
- Podcast: Ο Διονύσης Σιμόπουλος απαντά σε ερωτήματα για το σύμπαν και την έρευνα που σχετίζεται με αυτό
- Άρθρο με αφορμή το Nobel Φυσικής του 2017: Οι βηματισμοί της Επιστήμης και η πορεία προς τον εντοπισμό των βαρυτικών κυμάτων
- Συνέντευξη: Το ελληνικό εκπαιδευτικό σύστημα με τα μάτια ενός νέου ερευνητή όπως ο κ. Μπάμπουλης (Μέρος 3)
- Συνέντευξη: Ο ερευνητής Νανοτεχνολογίας κ. Μπάμπουλης περιγράφει τη δομή των νέων 2D υλικών και τις εφαρμογές τους (Μέρος 2)
- Συνέντευξη: Συζητώντας με τον ερευνητή κ. Παντελή Μπάμπουλη για τα ενδιαφέροντα τεχνητά υλικά, γερμανένιο και πυριτένιο (Μέρος 1)
- podcast: Τι είναι τα Βαρυτικά Κύματα (Συνέντευξη με τον Ερωτόκριτο Κατσαβουνίδη, διευθυντή έρευνας στο ΜΙΤ)
- podcast: Αναζητώντας τα Βαρυτικά Κύματα (Συνέντευξη με τον Χρήστο Τσάγκα, Αναπληρωτή Καθηγητή του ΑΠΘ)
Ερευνητές ανακάλυψαν ένα νέο δρόμο για τον έλεγχο της όρεξης

Μια νέα μελέτη αποκάλυψε σημαντικές λεπτομέρειες ενός συστήματος μοριακής σηματοδότησης στον εγκέφαλο, που εμπλέκεται στον έλεγχο του σωματικού βάρους και του μεταβολισμού. Η μελέτη που δημοσιεύτηκε στο περιοδικό Nature, προσφέρει μια νέα αντίληψη για τον τρόπο με τον οποίο λειτουργεί η ορμόνη α-μελανοκορτίνη και θα μπορούσε να οδηγήσει σε νέες θεραπείες για την παχυσαρκία.
Ένας εκ των συγγραφέων της μελέτης, ο Glenn Millhauser, καθηγητής χημείας και βιοχημείας στο πανεπιστήμιο της Santa Cruz, δήλωσε ότι τα ευρήματα είναι πολύ συναρπαστικά και έχουν ευρείες επιπτώσεις στην βιοιατρική. «Είμαστε πολύ κοντά στα πραγματικά μοριακά χαρακτηριστικά του τι ελέγχει αυτό το σημαντικό σύστημα σηματοδότησης στον εγκέφαλο», ανέφερε.
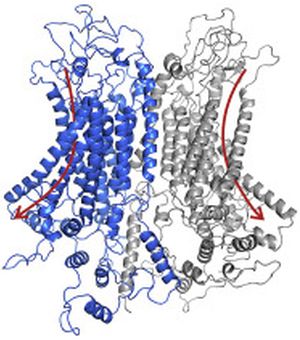
Η μελέτη, που καθοδηγήθηκε από ερευνητές του Πανεπιστημίου του Vanderbilt, επικεντρώθηκε σε έναν υποδοχέα ενσωματωμένο στις μεμβράνες των νευρικών κυττάρων που ονομάζεται υποδοχέας μελανοκορτίνης 4 ή MC4R. Ανήκει σε μια κατηγορία υποδοχέων, γνωστή ως υποδοχείς πρωτεΐνης G (GPCRs), οι οποίοι συνήθως ενεργούν σαν διακόπτες στέλνοντας σήματα σε σύντομα χρονικά πλαίσια, σύμφωνα με τον Roger Cone, ο οποίος ηγήθηκε της μελέτης του Vanderbilt.
«Το εύρημα αυτό προσδιορίζει ένα μοριακό μηχανισμό για τη μετατροπή ενός διακόπτη on-off σε ροοστάτη», δήλωσε ο Cone. «Αυτό θα μπορούσε να εξηγήσει αργές αλλά σταθερές βιολογικές διαδικασίες, οι οποίες διαμεσολαβούνται από τους GPCRs, όπως είναι για παράδειγμα η επαναπρόσληψη βάρους μετά από δίαιτα».
Το εργαστήριο του Millhauser έχει κάνει εκτεταμένη έρευνα για πρωτεΐνες που δεσμεύονται με τον υποδοχέα MC4R, όπως η AgRP, πρωτεΐνη που έχει ένα είδος αρουραίου της Κεντρικής Αμερικής. Η AgPR, είναι ένα ισχυρό διεγερτικό της όρεξης. Ο ρόλος της στη ρύθμιση του ενεργειακού ισοζυγίου είναι να καταστείλει το μεταβολισμό και να αυξήσει την διατροφή όταν το σώμα χρειάζεται να πάρει βάρος και να αποθηκεύσει ενέργεια. Στο εργαστήριο έχουν αναπτύξει τροποποιημένες εκδοχές της πρωτεΐνης AgRP που μεταβάλουν την δράση της. Στη μελέτη, οι τροποποιημένες πρωτεΐνες βοήθησαν τους ερευνητές να εντοπίσουν μια άγνωστη μέχρι πρότινος επίδραση της AgRP.
Στο εργαστήριο ανακάλυψαν επίσης μια ακόμα πρωτεΐνη – ένα κανάλι Καλίου που ονομάζεται Kir7.1 – αυτή η πρωτεΐνη συντροφεύει τον υποδοχέα MC4R και λειτουργεί ανεξάρτητα από τη σηματοδότηση της πρωτεΐνης G. Οι ερευνητές βρήκαν ότι η πρωτεΐνη AgRP επάγει τον υποδοχέα MC4R να ανοίξει το κανάλι του καλίου, το οποίο υπερπολώνει και αναστέλλει τους νευρώνες που εμπλέκονται στην διακοπή της όρεξης. Τροποποιήσεις της πρωτεΐνης AgRP μπορούν να οδηγήσουν στην αύξηση ή στη μείωση του δέκτη στο κανάλι του καλίου. Αυτές οι έννοιες θα μπορούσαν τελικά να οδηγήσουν σε νέες θεραπείες για τις μεταβολικές διαταραχές, όπως η παχυσαρκία, η ανορεξία κ. α.
Πηγή: University of California Santa Cruz
Περισσότερα στο άρθρο: G-protein-independent coupling of MC4R to Kir7.1 in hypothalamic neurons, Nature (2015)